 Реклама Google — средство выживания форумов :)
Реклама Google — средство выживания форумов :)
-
/1101553-item_2413.jpg)
Карамельное беспокойство II
Теги:
Кстати я тут плавил KNO3 без термостата (на лите в тигле). Дымит зараза. Кидаешь в него крупинку сахара - она сгорает. Не нравиться мне это.  Или эвтектика лучше себя ведет? Как я понял жидкую смесь без нитрата натрия получить нельзя?
Или эвтектика лучше себя ведет? Как я понял жидкую смесь без нитрата натрия получить нельзя?
Это я не к тому, что составы хочу отрабатывать, а к тому, что хочу посмотреть как кармелька горит (аналогия с ПКХ, а то тут начнут планы строить, я знаю )
)
 Или эвтектика лучше себя ведет? Как я понял жидкую смесь без нитрата натрия получить нельзя?
Или эвтектика лучше себя ведет? Как я понял жидкую смесь без нитрата натрия получить нельзя? Это я не к тому, что составы хочу отрабатывать, а к тому, что хочу посмотреть как кармелька горит (аналогия с ПКХ, а то тут начнут планы строить, я знаю
 )
)
Shadows of Invasion.
algor17
опытный
Начал сверлить гильзу - а топливо внутри мягкое! У сорбита есть такое свойство: после плавления и охлаждения он не сразу кристаллизуется, а в течение 1-2 дней. Я об этом знал, Накка и другие карамельщики писали, поэтому контролировал застывание всех составов. Но только снаружи! Сразу после охлаждения они немного мягкие, продавливаются ногтём, а на следующий день все были твёрдые, как камешки. А внутри я конечно не ковырял.
Вчера избыток топлива, не поместившийся в гильзу, вылил на бумагу, сегодня эта лужица сверху тоже совсем твёрдая. Я её разломил, оказывается твёрдый слой меньше 1мм, остальные внутренности мягкие.
Получается, что нужно переделывать все тесты, потому что наверняка все шашки внутри были мягкие, а это должно сильно влиять на скорость горения. Может быть твёрдые будут гореть ещё быстрее.
Вчера избыток топлива, не поместившийся в гильзу, вылил на бумагу, сегодня эта лужица сверху тоже совсем твёрдая. Я её разломил, оказывается твёрдый слой меньше 1мм, остальные внутренности мягкие.
Получается, что нужно переделывать все тесты, потому что наверняка все шашки внутри были мягкие, а это должно сильно влиять на скорость горения. Может быть твёрдые будут гореть ещё быстрее.
Селитры — это соли азотной кислоты. Если вы помните, мы уже упоминали об экзотермическом распаде аммиачной селитры (нитрата аммония):
(1) NН4NО3=0,5 N02+0,75 N2+2 Н20
(2) NН4NО3=N2+2 Н2O+0,5 02
Эти реакции сопровождаются выделением тепла, соответственно 102 и 119 кДж на 1моль исходного нитрата аммония. Нетрудно заметить, что в молекуле NH4NO3 присутствуют одновременно окислитель (N+5) и восстановители (N-3, 0-2). Если энергия, выделяющаяся при распаде такой молекулы, может вызвать аналогичное превращение хотя бы одной из соседних молекул, вполне возможно, что эти реакции будут протекать со взрывом. Увы, это предположение нашло не одно подтверждение. Первый серьезный “эксперимент” — происшествие на складе химического завода в Оппау (Германия, 1921 г.). Там пытались раздробить слежавшуюся массу смеси нитрата и сульфата аммония небольшими зарядами динамита. Масса сдетонировала, в результате погибло около 1000 человек, разрушены сотни зданий. С тех пор произошло более 40 крупных аварий, связанных с детонацией нитрата аммония.
На основе нитрата аммония изготовляют недорогие бризантные смеси — аммоналы (избыток кислорода используется для окисления порошка алюминия) и аммотолы (смесь “кислородоизбыточного” NH4NО3 с “кислородонедостаточным” тринитротолуолом СН3С6Н3(N02)3 ). Аналогичные свойства проявляет другая аммониевая соль — перхлорат.
Способность нитрата аммония к самопроизвольному разложению в присутствии катализатора вы уже проверяли экспериментально (см. “Химию и жизнь” 1993, № 9). Логично предположить, что смесь нитрата аммония с углем будет замечательно гореть по уравнению:
(3) NН4NО3 + 0,5 С = 2 Н20+N2+0,5 СО2
Сравним тепловой эффект реакции (3) с тепловым эффектом реакции (4);
(4) 2 КNО3+2,5 С = К20+N2+2,5 СO2
Для реакции (3) получаем :
D Н°298 = [(2 * (--242) + (0,5 * (— 394)) — (—365)]= —316кДж;
Для реакции (4) :
D Н°298 = [(—362) + (2,5. * ( -394)] — (2 * ( —495)]= —357 кДж.
Но надо учесть, что первая цифра относится к 86 г смеси, а вторая к 232 г. На килограмм стехиометрической смеси нитрата аммония с углем получаем энтальпию — 3674 кДж, а на килограмм нитрата калия с углем —1539 кДж.
Так что, если судить по уравнению (4) и термохимическому расчету, нират аммония — идеальный окислитель для пороховой смеси. Однако те из вас, кто видел эту соль, наверное, заметили, что в ней много влажных комков — недаром аммиачную селитру, используемую для удобрения, гранулируют. Очень высокая растворимость нитрата аммония не позволит держать порох сухим, поскольку данная соль впитывает пары воды из воздуха при относительной влажности более 67 % (эта гигроскопическая точка соответствует относительной влажности воздуха над насыщенным раствором соли при 20 °С). Пиротехники знают, что не стоит готовить смеси с солями, гигроскопическая точка которых ниже 75 %.
(1) NН4NО3=0,5 N02+0,75 N2+2 Н20
(2) NН4NО3=N2+2 Н2O+0,5 02
Эти реакции сопровождаются выделением тепла, соответственно 102 и 119 кДж на 1моль исходного нитрата аммония. Нетрудно заметить, что в молекуле NH4NO3 присутствуют одновременно окислитель (N+5) и восстановители (N-3, 0-2). Если энергия, выделяющаяся при распаде такой молекулы, может вызвать аналогичное превращение хотя бы одной из соседних молекул, вполне возможно, что эти реакции будут протекать со взрывом. Увы, это предположение нашло не одно подтверждение. Первый серьезный “эксперимент” — происшествие на складе химического завода в Оппау (Германия, 1921 г.). Там пытались раздробить слежавшуюся массу смеси нитрата и сульфата аммония небольшими зарядами динамита. Масса сдетонировала, в результате погибло около 1000 человек, разрушены сотни зданий. С тех пор произошло более 40 крупных аварий, связанных с детонацией нитрата аммония.
На основе нитрата аммония изготовляют недорогие бризантные смеси — аммоналы (избыток кислорода используется для окисления порошка алюминия) и аммотолы (смесь “кислородоизбыточного” NH4NО3 с “кислородонедостаточным” тринитротолуолом СН3С6Н3(N02)3 ). Аналогичные свойства проявляет другая аммониевая соль — перхлорат.
Способность нитрата аммония к самопроизвольному разложению в присутствии катализатора вы уже проверяли экспериментально (см. “Химию и жизнь” 1993, № 9). Логично предположить, что смесь нитрата аммония с углем будет замечательно гореть по уравнению:
(3) NН4NО3 + 0,5 С = 2 Н20+N2+0,5 СО2
Сравним тепловой эффект реакции (3) с тепловым эффектом реакции (4);
(4) 2 КNО3+2,5 С = К20+N2+2,5 СO2
Для реакции (3) получаем :
D Н°298 = [(2 * (--242) + (0,5 * (— 394)) — (—365)]= —316кДж;
Для реакции (4) :
D Н°298 = [(—362) + (2,5. * ( -394)] — (2 * ( —495)]= —357 кДж.
Но надо учесть, что первая цифра относится к 86 г смеси, а вторая к 232 г. На килограмм стехиометрической смеси нитрата аммония с углем получаем энтальпию — 3674 кДж, а на килограмм нитрата калия с углем —1539 кДж.
Так что, если судить по уравнению (4) и термохимическому расчету, нират аммония — идеальный окислитель для пороховой смеси. Однако те из вас, кто видел эту соль, наверное, заметили, что в ней много влажных комков — недаром аммиачную селитру, используемую для удобрения, гранулируют. Очень высокая растворимость нитрата аммония не позволит держать порох сухим, поскольку данная соль впитывает пары воды из воздуха при относительной влажности более 67 % (эта гигроскопическая точка соответствует относительной влажности воздуха над насыщенным раствором соли при 20 °С). Пиротехники знают, что не стоит готовить смеси с солями, гигроскопическая точка которых ниже 75 %.
[ слишком длинный топик - автонарезка ]
Гигроскопическая точка нитрата натрия — 77%, нитрата калия — 92,5%. В средней полосе относительная влажность воздуха часто превышает 80 % , при этом смеси на основе натриевой и аммиачной селитры быстро отсыреют. А примесь влаги в горючей смеси, как вы помните из предыдущих статей, снижает скорость горения.
Есть еще одна причина того, что смеси с окислителями-солями аммония — горят медленно. Не только известный вам хлорид, но и практически все остальные аммониевые соли способны возгоняться. Причем при возгонке аммиачная селитра начинает разлагаться:
(5) NН4NO3= NН3 + НNО3 —174,4 кДж .
При 200 °С давление паров над нитратом аммония составляет уже 839 Па и равновесие заметно сдвинуто вправо. При более высокой температуре начинаются реакции аммиака с азотной кислотой. Но этим экзотермическим реакциям предшествует эндотермическая стадия возгонки, охлаждающая поверхность горящей смеси. В результате смеси на основе нитрата аммония горят очень медленно, хотя и детонируют. Что ж, придется для будущих фейерверков доставать нитрат калия. В продаже встречаются удобрения — натриевая и аммиачная селитры. Их можно использовать для приготовления калиевой селитры.
Для того чтобы получить нитрат калия из аммиачной селитры, удобнее всего использовать карбонат калия (поташ), который продается в фотомагазинах. Приготовьте насыщенные растворы из рассчитанных количеств солей, слейте их и кипятите под тягой или на открытом воздухе:
(6) 2 NН4NО3 + К2СО3 = 2 КNО3 + 2 NН3 + С02 + Н2О
Кстати, эта реакция происходила и в древних ямах-селитряницах, где органические остатки были перемешаны с золой, содержащей много поташа.
Есть еще одна причина того, что смеси с окислителями-солями аммония — горят медленно. Не только известный вам хлорид, но и практически все остальные аммониевые соли способны возгоняться. Причем при возгонке аммиачная селитра начинает разлагаться:
(5) NН4NO3= NН3 + НNО3 —174,4 кДж .
При 200 °С давление паров над нитратом аммония составляет уже 839 Па и равновесие заметно сдвинуто вправо. При более высокой температуре начинаются реакции аммиака с азотной кислотой. Но этим экзотермическим реакциям предшествует эндотермическая стадия возгонки, охлаждающая поверхность горящей смеси. В результате смеси на основе нитрата аммония горят очень медленно, хотя и детонируют. Что ж, придется для будущих фейерверков доставать нитрат калия. В продаже встречаются удобрения — натриевая и аммиачная селитры. Их можно использовать для приготовления калиевой селитры.
Для того чтобы получить нитрат калия из аммиачной селитры, удобнее всего использовать карбонат калия (поташ), который продается в фотомагазинах. Приготовьте насыщенные растворы из рассчитанных количеств солей, слейте их и кипятите под тягой или на открытом воздухе:
(6) 2 NН4NО3 + К2СО3 = 2 КNО3 + 2 NН3 + С02 + Н2О
Кстати, эта реакция происходила и в древних ямах-селитряницах, где органические остатки были перемешаны с золой, содержащей много поташа.
Д.Б.>Селитры — это соли азотной кислоты.........
Хорошо! Это из Химии и Жизни? А ещё про НА что-нибудь есть?
Хорошо! Это из Химии и Жизни? А ещё про НА что-нибудь есть?
Занятие №3
Итак, уважаемые читатели, у нас появилась возможность предсказать для еще не приготовленной смеси, загорится ли она. Можно даже оценить, насколько горячим будет наше теоретическое пламя. Между тем термохимический расчет не поможет оценить скорость реакции горения. Здесь теория работает гораздо хуже. Например, перед полетами “Шатла” и “Бурана” ученые много лет исследовали очень сложный процесс взаимодействия водорода с кислородом, который включает множество стадий и промежуточных продуктов. Даже современные компьютеры не позволят провести полный кинетический расчет (т. е. расчет скорости реакции) в известной почти полтора тысячелетия трехкомпонентной системе — черном порохе. Ведь при его сгорании получаются десятки стабильных и метастабильных продуктов (сравните с системой водород — кислород).
Но если вы задумали изготовить для модели ракеты твердое топливо по собственному рецепту, вам просто необходимо заранее прикинуть скорость горения смеси в рыхлом и спрессованном виде и, что очень важно, оценить зависимость скорости горения от давления. (Думаю, что, пользуясь уравнением реакции и газовыми законами, вы сумеете рассчитать объем продуктов сгорания на единицу объема смеси. От этого зависит главная характеристика ракетного топлива — удельный импульс тяги.)
Несколько экспериментов помогут понять, что происходит в пиротехнических смесях в момент зажигания. Для начала вам понадобятся весы, позволяющие взвешивать до 20 г с точностью 0,1 г (сделать их самому не очень трудно); ступка объемом 300—500 мл с пестиком (обязательно фарфоровые, чугунные использовать нельзя!); парафиновая или стеариновая свеча, нитрат калия, черный (то есть хорошо прокаленный) древесный уголь (только не из выброшенного противогаза или отработанного заводского фильтра: такой уголь выделяет все ранее поглощенные вредные вещества); “сухое горючее” — уротропин (гексаметилентетрамин). Сжигать образцы пиросмесей надо на несгораемой подставке — удобно использовать куски керамической облицовочной плитки. А хранить готовые пиротехнические смеси лучше в пластмассовой, а не стеклянной посуде.
Эксперимент 1. Медленно поднесите горящую спичку к свече и внимательно наблюдайте за фитилем. Парафин сначала расплавится, затем задымится — вы увидите туман его остывающих паров. Только после этого свеча загорится, то есть вспыхнут пары вокруг фитиля. Попробуйте теперь спичкой зажечь кусок парафина, лежащий на несгораемой подставке. Вам это не удастся до тех пор, пока уголек от сгоревшей спички не коснется капли расплава парафина.
Следовательно, твердый или жидкий парафин на воздухе не горит — горят его пары, которые выделяет тонкий, хорошо прогреваемый фитиль.
Эксперимент 2. Тщательно разотрите смесь нитрата калия (калиевой селитры) и древесного угля в соотношении 4:1 (2 г селитры и 0,5 г угля). Сначала разотрите в ступке уголь до исчезновения слегка поблескивающих крупинок, затем продолжайте растирание, добавляя по частям навеску селитры. Растирать нитрат и уголь вместе будет безопасно, если пестик со ступкой, уголь и селитра не содержат даже малейших следов перманганатов, перхлоратов, хлоратов и броматов; не допускаются удары, способные высечь искру. Чугунные ступки непригодны именно из-за искрения даже при слабых ударах. Нитрат калия во многих наших экспериментах можно заменить нитратом натрия (но не аммония!). Для этого, пользуясь таблицей 1 (см. предыдущее занятие), нужно пересчитать массу окислителя, исходя из содержания активного кислорода. Пример такого расчета: 2 г нитрата калия содержат 40 % или 0,8 г акт. [О]. Если оставить неизменной массу горючего (0,5 г угля), то потребуется масса нитрата натрия, содержащего 47 % акт. [О]: 0,8 г: 0,47= =1,7 г.
Теперь приготовьте около 2 г стехиометрической смеси нитрата с уротропином. Для расчета уравняйте реакцию:
КNО3+ (СН2)6N4 = K2O+СO2+Н2O+N2.
Проверьте себя — после округления массы должны примерно соотноситься как 5:1. Начать растирать смесь удобнее с уротропина.
Насыпьте на несгораемую подставку конической кучкой диаметром 5— 6 мм и высотой 2—3 мм немного смеси с углем.
Внимание! Образец для сжигания надо удалить от готовых смесей и реактивов минимум на 2 метра (я бы посоветовал всем начинающим пиротехникам особо обратить внимание на расстояние от места испытания до места хранения общей смеси. Поскольку эта основная ошибка новичка, и связанные с этим, ремонт квартиры и посещение больницы. Советую при экспериментах всегда держать наготове ведро воды.). Образец лучше поместить в хорошо проветриваемое место или под тягу. Рядом не должно быть горючих предметов (ваты, бумаги, тряпок)!
Медленно поднося сверху горящую спичку, подожгите смесь. Точно так подожгите такую же кучку смеси с уротропином. Затем возьмите по 0,5 г каждой из смесей и тщательно их перемешайте. А теперь попробуйте поджечь кучку “гибридной” смеси. В своем лабораторном журнале запишите составы смесей и характер их горения. Оставшиеся смеси высыпьте в банки с этикетками.
Внимание! У вас должно стать привычкой, что банки с пиротехническими смесями надо немедленно надписывать, причем не условными шифрами. Лучше наклеивать этикетки, где указан полный состав и дата изготовления.
Если вы растерли исходные смеси достаточно тщательно, то смесь с углем сгорела быстро, хотя и с трудом загорелась; в смеси с уротропином сначала мог загореться уротропин и даже почти весь сгореть до начала совместного горения с селитрой (слабое мало окрашенное пламя). “Гибридная” смесь загорелась легко и сгорела довольно быстро, хотя медленнее, чем смесь с углем. Теперь подумайте — какая может быть связь между экспериментами 1 и 2? От чего зависит способность смеси воспламеняться и скорость горения? Наши эксперименты показали, что основные реакции горения пиротехнических смесей протекают не в твердой, а в газовой фазе. Чтобы поджечь смесь селитры с углем, вам понадобилось сначала расплавить селитру. При этом в газокапельном слое над твердой смесью, образованном продуктами сгорания, жидкими микрокаплями оксида, нитрата и нитрита калия, идет быстрая реакция. А вот смесь с легко сублимирующимся уротропином загорается гораздо легче, но значительная часть тепла реакции расходуется на возгонку горючего — селитра плохо прогревается и медленно разлагается. Много тепла уносят и пары воды. “Гибридная” смесь сочетает легкость загорания уротропина и высокую теплоту горения углерода, поэтому горит достаточно быстро.
Общие выводы: реакция горения пиротехнической смеси обычно начинается в газовой или жидкой фазе;
горение происходит в газовом или газокапельном слое у поверхности твердой смеси; скорость горения смеси определяется сочетанием процессов плавления, испарения, выделения тепла в зоне реакции, расходованием его на фазовые переходы и уносом энергии продуктами с высокой теплоемкостью (вода).
Итак, уважаемые читатели, у нас появилась возможность предсказать для еще не приготовленной смеси, загорится ли она. Можно даже оценить, насколько горячим будет наше теоретическое пламя. Между тем термохимический расчет не поможет оценить скорость реакции горения. Здесь теория работает гораздо хуже. Например, перед полетами “Шатла” и “Бурана” ученые много лет исследовали очень сложный процесс взаимодействия водорода с кислородом, который включает множество стадий и промежуточных продуктов. Даже современные компьютеры не позволят провести полный кинетический расчет (т. е. расчет скорости реакции) в известной почти полтора тысячелетия трехкомпонентной системе — черном порохе. Ведь при его сгорании получаются десятки стабильных и метастабильных продуктов (сравните с системой водород — кислород).
Но если вы задумали изготовить для модели ракеты твердое топливо по собственному рецепту, вам просто необходимо заранее прикинуть скорость горения смеси в рыхлом и спрессованном виде и, что очень важно, оценить зависимость скорости горения от давления. (Думаю, что, пользуясь уравнением реакции и газовыми законами, вы сумеете рассчитать объем продуктов сгорания на единицу объема смеси. От этого зависит главная характеристика ракетного топлива — удельный импульс тяги.)
Несколько экспериментов помогут понять, что происходит в пиротехнических смесях в момент зажигания. Для начала вам понадобятся весы, позволяющие взвешивать до 20 г с точностью 0,1 г (сделать их самому не очень трудно); ступка объемом 300—500 мл с пестиком (обязательно фарфоровые, чугунные использовать нельзя!); парафиновая или стеариновая свеча, нитрат калия, черный (то есть хорошо прокаленный) древесный уголь (только не из выброшенного противогаза или отработанного заводского фильтра: такой уголь выделяет все ранее поглощенные вредные вещества); “сухое горючее” — уротропин (гексаметилентетрамин). Сжигать образцы пиросмесей надо на несгораемой подставке — удобно использовать куски керамической облицовочной плитки. А хранить готовые пиротехнические смеси лучше в пластмассовой, а не стеклянной посуде.
Эксперимент 1. Медленно поднесите горящую спичку к свече и внимательно наблюдайте за фитилем. Парафин сначала расплавится, затем задымится — вы увидите туман его остывающих паров. Только после этого свеча загорится, то есть вспыхнут пары вокруг фитиля. Попробуйте теперь спичкой зажечь кусок парафина, лежащий на несгораемой подставке. Вам это не удастся до тех пор, пока уголек от сгоревшей спички не коснется капли расплава парафина.
Следовательно, твердый или жидкий парафин на воздухе не горит — горят его пары, которые выделяет тонкий, хорошо прогреваемый фитиль.
Эксперимент 2. Тщательно разотрите смесь нитрата калия (калиевой селитры) и древесного угля в соотношении 4:1 (2 г селитры и 0,5 г угля). Сначала разотрите в ступке уголь до исчезновения слегка поблескивающих крупинок, затем продолжайте растирание, добавляя по частям навеску селитры. Растирать нитрат и уголь вместе будет безопасно, если пестик со ступкой, уголь и селитра не содержат даже малейших следов перманганатов, перхлоратов, хлоратов и броматов; не допускаются удары, способные высечь искру. Чугунные ступки непригодны именно из-за искрения даже при слабых ударах. Нитрат калия во многих наших экспериментах можно заменить нитратом натрия (но не аммония!). Для этого, пользуясь таблицей 1 (см. предыдущее занятие), нужно пересчитать массу окислителя, исходя из содержания активного кислорода. Пример такого расчета: 2 г нитрата калия содержат 40 % или 0,8 г акт. [О]. Если оставить неизменной массу горючего (0,5 г угля), то потребуется масса нитрата натрия, содержащего 47 % акт. [О]: 0,8 г: 0,47= =1,7 г.
Теперь приготовьте около 2 г стехиометрической смеси нитрата с уротропином. Для расчета уравняйте реакцию:
КNО3+ (СН2)6N4 = K2O+СO2+Н2O+N2.
Проверьте себя — после округления массы должны примерно соотноситься как 5:1. Начать растирать смесь удобнее с уротропина.
Насыпьте на несгораемую подставку конической кучкой диаметром 5— 6 мм и высотой 2—3 мм немного смеси с углем.
Внимание! Образец для сжигания надо удалить от готовых смесей и реактивов минимум на 2 метра (я бы посоветовал всем начинающим пиротехникам особо обратить внимание на расстояние от места испытания до места хранения общей смеси. Поскольку эта основная ошибка новичка, и связанные с этим, ремонт квартиры и посещение больницы. Советую при экспериментах всегда держать наготове ведро воды.). Образец лучше поместить в хорошо проветриваемое место или под тягу. Рядом не должно быть горючих предметов (ваты, бумаги, тряпок)!
Медленно поднося сверху горящую спичку, подожгите смесь. Точно так подожгите такую же кучку смеси с уротропином. Затем возьмите по 0,5 г каждой из смесей и тщательно их перемешайте. А теперь попробуйте поджечь кучку “гибридной” смеси. В своем лабораторном журнале запишите составы смесей и характер их горения. Оставшиеся смеси высыпьте в банки с этикетками.
Внимание! У вас должно стать привычкой, что банки с пиротехническими смесями надо немедленно надписывать, причем не условными шифрами. Лучше наклеивать этикетки, где указан полный состав и дата изготовления.
Если вы растерли исходные смеси достаточно тщательно, то смесь с углем сгорела быстро, хотя и с трудом загорелась; в смеси с уротропином сначала мог загореться уротропин и даже почти весь сгореть до начала совместного горения с селитрой (слабое мало окрашенное пламя). “Гибридная” смесь загорелась легко и сгорела довольно быстро, хотя медленнее, чем смесь с углем. Теперь подумайте — какая может быть связь между экспериментами 1 и 2? От чего зависит способность смеси воспламеняться и скорость горения? Наши эксперименты показали, что основные реакции горения пиротехнических смесей протекают не в твердой, а в газовой фазе. Чтобы поджечь смесь селитры с углем, вам понадобилось сначала расплавить селитру. При этом в газокапельном слое над твердой смесью, образованном продуктами сгорания, жидкими микрокаплями оксида, нитрата и нитрита калия, идет быстрая реакция. А вот смесь с легко сублимирующимся уротропином загорается гораздо легче, но значительная часть тепла реакции расходуется на возгонку горючего — селитра плохо прогревается и медленно разлагается. Много тепла уносят и пары воды. “Гибридная” смесь сочетает легкость загорания уротропина и высокую теплоту горения углерода, поэтому горит достаточно быстро.
Общие выводы: реакция горения пиротехнической смеси обычно начинается в газовой или жидкой фазе;
горение происходит в газовом или газокапельном слое у поверхности твердой смеси; скорость горения смеси определяется сочетанием процессов плавления, испарения, выделения тепла в зоне реакции, расходованием его на фазовые переходы и уносом энергии продуктами с высокой теплоемкостью (вода).
Занятие №4
Попробуем разобраться, как влияют на скорость горения пиротехнических смесей различные физические факторы.
Эксперименты, в которых изменяли внешние газовые давления, показали, что скорость горения пиросмесей может довольно сильно зависеть от давления — с его увеличением все смеси горят быстрее. В то же время, если уменьшить давление до 1— 0, 1 мм. рт. ст., то некоторые пиросмеси вообще перестанут гореть. Это подтверждает, что экзотермические процессы горения идут в основном в газовом (газокапельном) слое. Когда давление растет, зона высокой температуры придвигается к конденсированной фазе. Тому несколько причин, во-первых, увеличивается скорость реакций (ведь она пропорциональна, как вы помните, концентрациям реагентов), во-вторых, увеличивается теплопроводность газа. Когда же давление уменьшается, наблюдается противоположная картина.
Можно, таким образом, разделить процесс горения пиросмеси на эндотермические (идущие с поглощением тепла) стадии плавления, испарения и разложения окислителей (они происходят на поверхности твердой фазы) и экзотермические реакции в газокапельном слое.
Вполне очевидно, что :
1. предварительно нагретые смеси могут гореть быстрее.
2.Лучшее измельчение ускоряет процессы.
3.Спрессованный (гранулированный) состав имеет меньшую поверхность и горит медленнее, но более равномерно, чем просто порошок.
К влиянию физических факторов можно отнести и то, что пиросмеси будут гореть медленнее, если добавить органические смолы, парафин, канифоль, уротропин, а также хлорид аммония. Эти вещества требуют дополнительной энергии на плавление и возгонку, а образующаяся при их сгорании вода (пар) обладает большой теплоемкостью, что снижает температуру газокапельного слоя. При этом температура может оказаться недостаточной для разложения окислителя, тогда смесь перестанет гореть.
К химическим факторам, влияющим на скорость горения, относятся индивидуальные свойства веществ, от которых зависят температура и теплота разложения окислителей, а также теплота сгорания горючего и теплоемкость продуктов реакции.
Разумеется, скорость горения зависит от соотношения компонентов в смеси и наличия катализаторов разложения окислителя.
Быстрее всего горят стехиометрические смеси, то есть смеси, приготовленные в соответствии с уравнением реакции. При этом, как мы говорили раньше, необходимо правильно выбрать уравнение, исходя из термохимических данных.
На практике почти не используют смеси, состоящие только из одного окислителя и одного горючего. Стехиометрическое соотношение тоже часто специально нарушается — во многих случаях необходим избыток горючего.
Учитывая, что главным праздником для пиротехников является Новый год и Рождество, рассмотрим роль компонентов в пиротехнической смеси на примере хорошо всем знакомой искристой свечи, которую традиционно и неправильно называют “бенгальский огонь”. Искристая свеча — это стальная проволока диаметром 0,8—1,5 мм и длиной 15—25 см, на которую обычно наклеен следующий состав:
чугунные опилки — 30 % (по массе);
Ва(NО3)2 — 50 %;
алюминий (пудра) — 6 %;
декстрин (крахмал) — 14 %.
Стоит изменить соотношения или заменить один компонент на другой, как свеча будет гореть хуже. Проверим это экспериментально.
Эксперимент 3. Очень велик соблазн взять вместо чугунных опилок порошок железа (железо, восстановленное водородом), который есть в школьных химических кабинетах и наборе “Юный химик”. Тем не менее напилите хотя бы 0,1 г чугуна и сравните с чистым железом. Высыпайте понемногу металлический порошок на ламя горящей свечи. А затем проделайте то же с чугунными опилками. Оказывается, чистое железо дает при горении тусклые красноватые искры, а чугун — яркие. К тому же искры от чугуна красиво ветвятся. Дело в том, что в чугуне растворен углерод.
Попробуем разобраться, как влияют на скорость горения пиротехнических смесей различные физические факторы.
Эксперименты, в которых изменяли внешние газовые давления, показали, что скорость горения пиросмесей может довольно сильно зависеть от давления — с его увеличением все смеси горят быстрее. В то же время, если уменьшить давление до 1— 0, 1 мм. рт. ст., то некоторые пиросмеси вообще перестанут гореть. Это подтверждает, что экзотермические процессы горения идут в основном в газовом (газокапельном) слое. Когда давление растет, зона высокой температуры придвигается к конденсированной фазе. Тому несколько причин, во-первых, увеличивается скорость реакций (ведь она пропорциональна, как вы помните, концентрациям реагентов), во-вторых, увеличивается теплопроводность газа. Когда же давление уменьшается, наблюдается противоположная картина.
Можно, таким образом, разделить процесс горения пиросмеси на эндотермические (идущие с поглощением тепла) стадии плавления, испарения и разложения окислителей (они происходят на поверхности твердой фазы) и экзотермические реакции в газокапельном слое.
Вполне очевидно, что :
1. предварительно нагретые смеси могут гореть быстрее.
2.Лучшее измельчение ускоряет процессы.
3.Спрессованный (гранулированный) состав имеет меньшую поверхность и горит медленнее, но более равномерно, чем просто порошок.
К влиянию физических факторов можно отнести и то, что пиросмеси будут гореть медленнее, если добавить органические смолы, парафин, канифоль, уротропин, а также хлорид аммония. Эти вещества требуют дополнительной энергии на плавление и возгонку, а образующаяся при их сгорании вода (пар) обладает большой теплоемкостью, что снижает температуру газокапельного слоя. При этом температура может оказаться недостаточной для разложения окислителя, тогда смесь перестанет гореть.
К химическим факторам, влияющим на скорость горения, относятся индивидуальные свойства веществ, от которых зависят температура и теплота разложения окислителей, а также теплота сгорания горючего и теплоемкость продуктов реакции.
Разумеется, скорость горения зависит от соотношения компонентов в смеси и наличия катализаторов разложения окислителя.
Быстрее всего горят стехиометрические смеси, то есть смеси, приготовленные в соответствии с уравнением реакции. При этом, как мы говорили раньше, необходимо правильно выбрать уравнение, исходя из термохимических данных.
На практике почти не используют смеси, состоящие только из одного окислителя и одного горючего. Стехиометрическое соотношение тоже часто специально нарушается — во многих случаях необходим избыток горючего.
Учитывая, что главным праздником для пиротехников является Новый год и Рождество, рассмотрим роль компонентов в пиротехнической смеси на примере хорошо всем знакомой искристой свечи, которую традиционно и неправильно называют “бенгальский огонь”. Искристая свеча — это стальная проволока диаметром 0,8—1,5 мм и длиной 15—25 см, на которую обычно наклеен следующий состав:
чугунные опилки — 30 % (по массе);
Ва(NО3)2 — 50 %;
алюминий (пудра) — 6 %;
декстрин (крахмал) — 14 %.
Стоит изменить соотношения или заменить один компонент на другой, как свеча будет гореть хуже. Проверим это экспериментально.
Эксперимент 3. Очень велик соблазн взять вместо чугунных опилок порошок железа (железо, восстановленное водородом), который есть в школьных химических кабинетах и наборе “Юный химик”. Тем не менее напилите хотя бы 0,1 г чугуна и сравните с чистым железом. Высыпайте понемногу металлический порошок на ламя горящей свечи. А затем проделайте то же с чугунными опилками. Оказывается, чистое железо дает при горении тусклые красноватые искры, а чугун — яркие. К тому же искры от чугуна красиво ветвятся. Дело в том, что в чугуне растворен углерод.
[ слишком длинный топик - автонарезка ]
Maggot
втянувшийся
Так что придется вам взяться за напильник. Кстати, хрупкий чугун превращается в опилки довольно легко.
Эксперимент 4. Следующая проблема — довольно дефицитный нитрат бария. Сразу хочется заменить его хотя бы нитратом калия. Попытаемся это сделать. Приготовьте смесь № 1 из 5 г нитрата бария и 3 г чугунных опилок; затем смесь № 2, пересчитанную по содержанию кислорода в окислителе,— 1,2 г нитрата калия и 1,0 чугунных опилок. Попробуйте, как во втором эксперименте (см. предыдущее занятие), поджечь образцы этих смесей. Вряд ли у вас это получится. Придется ввести в составы более легко воспламеняемое горючее. К смеси № 1 добавьте 1,4 г крахмала, а к смеси № 2 — 0,4 г. Тщательно перемешайте (старайтесь не перетирать изо всех сил — может получиться малоискрящаяся чугунная пыль) и снова попробуйте поджечь. Обратите внимание на характер горения. Смесь № 2 легче воспламеняется, но образует раскаленную каплю и почти не искрит. Это связано с тем, что оксид и пероксиды калия плавятся при температуре ниже 600 °С, карбонат — при 900 °С, а оксид бария — выше 2000 °С. В результате выделяющийся в смеси № 2 азот не может вытолкнуть частицы металла, прилипшие к расплаву калиевого оксида.
Наконец добавьте к смеси № 1 0,5 г алюминиевой пудры, к смеси № 2 — чуть меньше 0,2 г. Теперь обе смеси достаточно легко воспламеняются и интенсивно горят, но все равно искрят по-разному. Кстати, масса смеси № 2 не случайно взята небольшой — чтобы не переводить зря реактивы.
Но главный недостаток смеси с нитратом калия в следующем: когда она горит на проволоке, то получается жидкий шлак, капающий вниз, а это совершенно недопустимо.
Эксперимент 5. Чтобы нанести искристый состав на проволоку, лучше использовать не крахмал, а сравнительно низкомолекулярный декстрин с той же брутто-формулой — (C6H10O5)n. Получить его можно из крахмала. Насыпьте порошок крахмала на металлический лист, утрамбуйте до 1— 1,5 мм и медленно нагрейте до потемнения и начала “плавления” (около 350 °С). После охлаждения стряхните неразложившийся крахмал: вам нужна темно-коричневая масса.
Эксперимент 6. Приготовьте нарезанную стальную проволоку. Не пытайтесь заменить ее алюминиевой или медной — они могут расплавиться. Заготовьте не менее 50 г смеси по приведенному выше рецепту. Сухую смесь лучше всего разводить в полиэтиленовой банке с обрезанным верхом объемом 100—200 мл (от шампуня, клея и т. п.). Когда смесь высохнет, ее остатки легко удалить из гибкой банки. Медленно добавляйте к сухой смеси воду и мешайте, пока не получите сметанообразную массу.
Проволоку покрывать смесью лучше в два приема. Обмакните и сушите ее в течение 0,5—1 часа (получается слой смеси до 1 мм). Затем обмакните снова. Общая толщина свечи должна составить 5—6 мм. Сушить свечи надо в вертикальном положении намазанной частью вниз, например втыкая проволоку в закрепленный на полке пластилин. Общее время сушки — не менее суток.
Проверьте после этого срока качество изделий. Если они горят равномерно, хорошо искрят и весь шлак удерживается на проволоке (зажгите свечу в полуметре над расстеленной газетой: на ней не должны появиться прожженные пятна) — можете дарить друзьям ваши искристые свечи.
Правила пользования обычные — не ближе 2 м от елки, бумаги, ваты, не бросайте куда попало только что сгоревшие и тем более горящие свечи.
Эксперимент 4. Следующая проблема — довольно дефицитный нитрат бария. Сразу хочется заменить его хотя бы нитратом калия. Попытаемся это сделать. Приготовьте смесь № 1 из 5 г нитрата бария и 3 г чугунных опилок; затем смесь № 2, пересчитанную по содержанию кислорода в окислителе,— 1,2 г нитрата калия и 1,0 чугунных опилок. Попробуйте, как во втором эксперименте (см. предыдущее занятие), поджечь образцы этих смесей. Вряд ли у вас это получится. Придется ввести в составы более легко воспламеняемое горючее. К смеси № 1 добавьте 1,4 г крахмала, а к смеси № 2 — 0,4 г. Тщательно перемешайте (старайтесь не перетирать изо всех сил — может получиться малоискрящаяся чугунная пыль) и снова попробуйте поджечь. Обратите внимание на характер горения. Смесь № 2 легче воспламеняется, но образует раскаленную каплю и почти не искрит. Это связано с тем, что оксид и пероксиды калия плавятся при температуре ниже 600 °С, карбонат — при 900 °С, а оксид бария — выше 2000 °С. В результате выделяющийся в смеси № 2 азот не может вытолкнуть частицы металла, прилипшие к расплаву калиевого оксида.
Наконец добавьте к смеси № 1 0,5 г алюминиевой пудры, к смеси № 2 — чуть меньше 0,2 г. Теперь обе смеси достаточно легко воспламеняются и интенсивно горят, но все равно искрят по-разному. Кстати, масса смеси № 2 не случайно взята небольшой — чтобы не переводить зря реактивы.
Но главный недостаток смеси с нитратом калия в следующем: когда она горит на проволоке, то получается жидкий шлак, капающий вниз, а это совершенно недопустимо.
Эксперимент 5. Чтобы нанести искристый состав на проволоку, лучше использовать не крахмал, а сравнительно низкомолекулярный декстрин с той же брутто-формулой — (C6H10O5)n. Получить его можно из крахмала. Насыпьте порошок крахмала на металлический лист, утрамбуйте до 1— 1,5 мм и медленно нагрейте до потемнения и начала “плавления” (около 350 °С). После охлаждения стряхните неразложившийся крахмал: вам нужна темно-коричневая масса.
Эксперимент 6. Приготовьте нарезанную стальную проволоку. Не пытайтесь заменить ее алюминиевой или медной — они могут расплавиться. Заготовьте не менее 50 г смеси по приведенному выше рецепту. Сухую смесь лучше всего разводить в полиэтиленовой банке с обрезанным верхом объемом 100—200 мл (от шампуня, клея и т. п.). Когда смесь высохнет, ее остатки легко удалить из гибкой банки. Медленно добавляйте к сухой смеси воду и мешайте, пока не получите сметанообразную массу.
Проволоку покрывать смесью лучше в два приема. Обмакните и сушите ее в течение 0,5—1 часа (получается слой смеси до 1 мм). Затем обмакните снова. Общая толщина свечи должна составить 5—6 мм. Сушить свечи надо в вертикальном положении намазанной частью вниз, например втыкая проволоку в закрепленный на полке пластилин. Общее время сушки — не менее суток.
Проверьте после этого срока качество изделий. Если они горят равномерно, хорошо искрят и весь шлак удерживается на проволоке (зажгите свечу в полуметре над расстеленной газетой: на ней не должны появиться прожженные пятна) — можете дарить друзьям ваши искристые свечи.
Правила пользования обычные — не ближе 2 м от елки, бумаги, ваты, не бросайте куда попало только что сгоревшие и тем более горящие свечи.
Купил сорбит. Случайно увидел в гастрономе фасовки по 0.5 кг, чуть меньше $2 за одну.
Расплавил. Сперва сорбит немного пенился (сох, наверное), потом получилась хорошо текучая жидкость.
После охлаждения не затвердела. Через сутки из равной поверхности поднялись кристаллы, поверхность твердая, но глубже жидкость. Еще через сутки без изменений. Поставил в холодильник. Посмотрим.
Похоже, сорбит твердый только в кристаллах, если аморфный, то получается не стекло, а смола.
Расплавил. Сперва сорбит немного пенился (сох, наверное), потом получилась хорошо текучая жидкость.
После охлаждения не затвердела. Через сутки из равной поверхности поднялись кристаллы, поверхность твердая, но глубже жидкость. Еще через сутки без изменений. Поставил в холодильник. Посмотрим.
Похоже, сорбит твердый только в кристаллах, если аморфный, то получается не стекло, а смола.
Maggot>Расплавил. Сперва сорбит немного пенился (сох, наверное), потом получилась хорошо текучая жидкость.
У меня сорбит после плавления при 120 и до примерно 140С мутноватый, потом начинает немного пениться, при 150-160С прекращает и становится совершенно прозрачным, очень слабо желтоватый. Потом до 200С не изменяется.
Maggot>После охлаждения не затвердела. Через сутки из равной поверхности поднялись кристаллы, поверхность твердая, но глубже жидкость. Еще через сутки без изменений.
У меня то же самое, только это не кристаллы поднимаются, а застеклованная корочка. Видимо на поверхности сорбит набирает немного влаги из воздуха, это способствует затвердеванию. А в глубину массы влага не проникает.
Ты взвесь до и после нагревания до 180С, определи содержание влаги.
Maggot>Похоже, сорбит твердый только в кристаллах, если аморфный, то получается не стекло, а смола.
Я специально сделал два образца стандартной карамели KNO3-сорбит, один при нагревании только до 120-130С, другой до 185С. Первый через сутки стал твёрдой карамелью, горел, как у Накки, 2.6мм/сек. Второй через сутки (вчера вечером) был чуть мягче, но всё-таки твёрже моих образцов, думаю, что через двое суток будет совсем твёрдым.
В моём сорбите 0.5% влаги, получается что она как раз способствует отверждению.
Вчера замешивал с повышенным содержанием крахмала, удалось 5% сорбита заменить на крахмал, при этом он почти весь растворился, получилась более густая масса. Посмотрим, что получится.
У меня сорбит после плавления при 120 и до примерно 140С мутноватый, потом начинает немного пениться, при 150-160С прекращает и становится совершенно прозрачным, очень слабо желтоватый. Потом до 200С не изменяется.
Maggot>После охлаждения не затвердела. Через сутки из равной поверхности поднялись кристаллы, поверхность твердая, но глубже жидкость. Еще через сутки без изменений.
У меня то же самое, только это не кристаллы поднимаются, а застеклованная корочка. Видимо на поверхности сорбит набирает немного влаги из воздуха, это способствует затвердеванию. А в глубину массы влага не проникает.
Ты взвесь до и после нагревания до 180С, определи содержание влаги.
Maggot>Похоже, сорбит твердый только в кристаллах, если аморфный, то получается не стекло, а смола.
Я специально сделал два образца стандартной карамели KNO3-сорбит, один при нагревании только до 120-130С, другой до 185С. Первый через сутки стал твёрдой карамелью, горел, как у Накки, 2.6мм/сек. Второй через сутки (вчера вечером) был чуть мягче, но всё-таки твёрже моих образцов, думаю, что через двое суток будет совсем твёрдым.
В моём сорбите 0.5% влаги, получается что она как раз способствует отверждению.
Вчера замешивал с повышенным содержанием крахмала, удалось 5% сорбита заменить на крахмал, при этом он почти весь растворился, получилась более густая масса. Посмотрим, что получится.
algor17
опытный
Maggot>Предел упругости шашки определяет зависимость толщины стенки шашки от ускорения.
Товарищи спецы, ну придумайте мне тест, как эту зависимость определить. Ну очень привлекательное топливо получается, жалко его бросать. А засунуть его в 50мм двигатель без хоть какой-нибудь уверенности, что топливо не стечёт и не забьёт сопло страшновато.
Товарищи спецы, ну придумайте мне тест, как эту зависимость определить. Ну очень привлекательное топливо получается, жалко его бросать. А засунуть его в 50мм двигатель без хоть какой-нибудь уверенности, что топливо не стечёт и не забьёт сопло страшновато.
Страшновато гришь.А ты ямку маленькую выкопай и туда его положь.
Maggot
втянувшийся
algor17>Страшновато гришь.А ты ямку маленькую выкопай и туда его положь.
Проблема в том, что при испытаниях на топливо не действует перегрузка, никуда оно не потечёт. А вот при старте ракеты может потечь, а проверить это в ямке невозможно. Поэтому нужен какой-то тест на прочность.
Проблема в том, что при испытаниях на топливо не действует перегрузка, никуда оно не потечёт. А вот при старте ракеты может потечь, а проверить это в ямке невозможно. Поэтому нужен какой-то тест на прочность.
timochka>Короче прикидывал я расчет топливной шашки. При не очень грубых допущениях получается 3-и независимые и не нулевые (в первом приближении) компоненты тензора деформации и система
Косяк! ^^^^^^ компоненты тензора НАПРЯЖЕНИЙ!
Косяк! ^^^^^^ компоненты тензора НАПРЯЖЕНИЙ!
timochka>R1 = R + (2 .. 3) * h.
Та часть, которая больше R, должна опираться на нижнюю опору?
timochka>Плавно наращиеваем нагрузку и смотрим при каком усилии начнется разрушение топливной пластины.
Нагрузку прикладывать сверху возле самого края внутреннего радиуса?
Что считать разрушением? Ведь сначала она начнёт немного ползти, а потом прорвётся.
Та часть, которая больше R, должна опираться на нижнюю опору?
timochka>Плавно наращиеваем нагрузку и смотрим при каком усилии начнется разрушение топливной пластины.
Нагрузку прикладывать сверху возле самого края внутреннего радиуса?
Что считать разрушением? Ведь сначала она начнёт немного ползти, а потом прорвётся.
timochka>>R1 = R + (2 .. 3) * h.
Serge77>Та часть, которая больше R, должна опираться на нижнюю опору?
Она должна и опираться на нижнюю, и упираться в верхнюю.
Т.е. консольно-защемленный край. Зазор должен быть минимален.
С края опоры надо снять фаски милиметра по 3. И потом еще скруглить край шкуркой.
timochka>>Плавно наращиеваем нагрузку и смотрим при каком усилии начнется разрушение топливной пластины.
Serge77>Нагрузку прикладывать сверху возле самого края внутреннего радиуса?
Да! Причем всегда вертикально, независимо от прогиба.
Serge77>Что считать разрушением? Ведь сначала она начнёт немного ползти, а потом прорвётся.
Когда пойдут трещины - разрушение. Ползти - не так важно. Т.к. время работы движка мало. Но если ползти начнет слишком рано, надо засечь нагрузку. Это даст предельное время работы для больших движков. Придется рассчитать время за которое топливо не уползет слишком далеко.
Можно конечно устроить гораздо более простое испытание, но тогда надо сначала довести до конца расчеты
Serge77>Та часть, которая больше R, должна опираться на нижнюю опору?
Она должна и опираться на нижнюю, и упираться в верхнюю.
Т.е. консольно-защемленный край. Зазор должен быть минимален.
С края опоры надо снять фаски милиметра по 3. И потом еще скруглить край шкуркой.
timochka>>Плавно наращиеваем нагрузку и смотрим при каком усилии начнется разрушение топливной пластины.
Serge77>Нагрузку прикладывать сверху возле самого края внутреннего радиуса?
Да! Причем всегда вертикально, независимо от прогиба.
Serge77>Что считать разрушением? Ведь сначала она начнёт немного ползти, а потом прорвётся.
Когда пойдут трещины - разрушение. Ползти - не так важно. Т.к. время работы движка мало. Но если ползти начнет слишком рано, надо засечь нагрузку. Это даст предельное время работы для больших движков. Придется рассчитать время за которое топливо не уползет слишком далеко.

Можно конечно устроить гораздо более простое испытание, но тогда надо сначала довести до конца расчеты

timochka>Когда пойдут трещины - разрушение. Ползти - не так важно. Т.к. время работы движка мало. Но если ползти начнет слишком рано, надо засечь нагрузку. Это даст предельное время работы для больших движков. Придется рассчитать время за которое топливо не уползет слишком далеко. 
Вроде бы всё прояснилось. На этой неделе у меня в планах определиться с окончательным составом топлива, начиная с понедельника я делаю составы с разным содержанием крахмала, в выходные их сожгу, по результатам выберу пару кандидатов. Вот для них и сделаю тесты на прочность.

Вроде бы всё прояснилось. На этой неделе у меня в планах определиться с окончательным составом топлива, начиная с понедельника я делаю составы с разным содержанием крахмала, в выходные их сожгу, по результатам выберу пару кандидатов. Вот для них и сделаю тесты на прочность.
Решил всеж таки привести рисунок как топливо нагружать.
Все делали цилиндрические
Деталь 1 имеет внутр. резьбу, деталь 2 наружную, диаметр резьбы R1.
3 и 4 - шайбы между которыми зажимается топливо. Внутренний диаметр этих шайб - R.
5 - верхняя упорная шайба. Ее внешний диаметр R0.
Диаметр отверстия в топливной шашке делается на 4 - 8 мм меньше R0. Внутренние края шайб 3 и 4, а также внешний край шайбы 5 скругляется по радиусу 3 мм.
Ну я грузики вешаем на крючок.

Все делали цилиндрические

Деталь 1 имеет внутр. резьбу, деталь 2 наружную, диаметр резьбы R1.
3 и 4 - шайбы между которыми зажимается топливо. Внутренний диаметр этих шайб - R.
5 - верхняя упорная шайба. Ее внешний диаметр R0.
Диаметр отверстия в топливной шашке делается на 4 - 8 мм меньше R0. Внутренние края шайб 3 и 4, а также внешний край шайбы 5 скругляется по радиусу 3 мм.
Ну я грузики вешаем на крючок.

Не такой уж я и спец. Десять лет пошло как сапромат сдал.
Думаю, надо пробовать шашку с каналом вклеенную в трубку бросать с высоты на пружину. При ударе о пужину будет аналогичная нагрузка как при полете. Грубо, отношение деформации пружины к высоте падения это отношение ускорения в момент торможения к ускорению свободного падения.
к ускорению свободного падения.
Думаю, наиболее нагруженным местом в шашке получится наружный диаметр сверху.
Думаю, надо пробовать шашку с каналом вклеенную в трубку бросать с высоты на пружину. При ударе о пужину будет аналогичная нагрузка как при полете. Грубо, отношение деформации пружины к высоте падения это отношение ускорения в момент торможения
 к ускорению свободного падения.
к ускорению свободного падения.Думаю, наиболее нагруженным местом в шашке получится наружный диаметр сверху.
Serge77>Проблема в том, что при испытаниях на топливо не действует перегрузка, никуда оно не потечёт. А вот при старте ракеты может потечь, а проверить это в ямке невозможно. Поэтому нужен какой-то тест на прочность.
Maggot>>>Трубка раньше выдерживала. Измениласть прочность топлива.
timochka>>Теперь большую долю нагрузки будет нести труба бронировки.
Maggot>А на что операется шашка, которая горит по торцам и каналу? Только на наружную стенку.
Точнее на трубку бронировки. В верхнем сечении ее загибает во внутрь (задача на устойчивость), в нижнем загибает наружу пока топливо еще не сгорело и сжимает вдоль оси все время.
НО бронировка - не проблема! Ее можно сделать очень прочной.
Нужно рассчитать топливо!
Maggot>>>Думаю, надо рассматривать сечение по радиусу толстостенной трубки закрепленной снаружи (за бронировку). Т.е. дефромацию на сдвиг по радиусу.
timochka>>Точно не так. Там зависимость будет нелинейная от радиуса. и хорошо если все ограничится параболой. Собственно текучесть топлива ограничит максимальный диаметр шашки. И только!
Maggot>Зависимость сдвига внутренних слоев топлива, для упугой деформации, действительно будет параболой, грубо.
Maggot>Предел упругости шашки определяет зависимость толщины стенки шашки от ускорения.
^ не "стенки шашки", а "стенки трубки". Макс. диаметр шашки определяет предел прочности. И закон Гука у нас уже не линейный . Т.е. теория упругости вместо сопромата.
. Т.е. теория упругости вместо сопромата.
Короче прикидывал я расчет топливной шашки. При не очень грубых допущениях получается 3-и независимые и не нулевые (в первом приближении) компоненты тензора деформации и система из 4-х не совсем линейных дифф ур-ов. 3-и из них я выписал (уравнения равновесия), дальше меня лень задавила (но результаты выложу чуть позже). Подумал я и решил что надо экспериментом смоделировать напряженно-деформированное состояние и получить эмпирическую зависимость.
Для таких видов материала как наше топливо критерием разрушения является достижение некоторой критической деформации (которая больше предела текучести для динамических нагрузок). Модуль упругости и предел текучести топлива влияют только на нагрузку действующую на трубу бронировки. Считая трубку бронировки бесконечно жесткой и отбрасывая неприятный вопрос и касательных напряжениях в материале можно сделать следующий тест.
Изготавливаем из топлива круглую пластину с отверстием по центру. h - толшина, R0 - внутр. R1 - внешн радиусы. Причем толщина кристалической корочки на поверхности топлива должна быть менее 0.1*h.
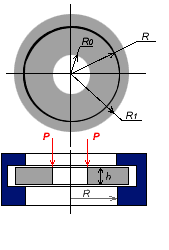
R0 - диаметр канала.
R - диаметр топливной шашки
R1 = R + (2 .. 3) * h.
P = m * g * n - усилие распределенное по внутреннему радиусу.
m - масса тестовой пластины находящаяся между радиусами R0 и R
( m = h * pi * (R2 - R02) * ro )
g - 9.8 м/с2
n - перегрузка, в разах.
Плавно наращиеваем нагрузку и смотрим при каком усилии начнется разрушение топливной пластины. Из этой критической нагрузки расчитываем макс. перегрузку для заданного диаметра движка.
Чертежи для испытательного стенда рисовать не буду, т.к. рисование чертежей в фотошопе - занятие для джедаев.
Maggot>>>Трубка раньше выдерживала. Измениласть прочность топлива.
timochka>>Теперь большую долю нагрузки будет нести труба бронировки.
Maggot>А на что операется шашка, которая горит по торцам и каналу? Только на наружную стенку.
Точнее на трубку бронировки. В верхнем сечении ее загибает во внутрь (задача на устойчивость), в нижнем загибает наружу пока топливо еще не сгорело и сжимает вдоль оси все время.
НО бронировка - не проблема! Ее можно сделать очень прочной.
Нужно рассчитать топливо!
Maggot>>>Думаю, надо рассматривать сечение по радиусу толстостенной трубки закрепленной снаружи (за бронировку). Т.е. дефромацию на сдвиг по радиусу.
timochka>>Точно не так. Там зависимость будет нелинейная от радиуса. и хорошо если все ограничится параболой. Собственно текучесть топлива ограничит максимальный диаметр шашки. И только!
Maggot>Зависимость сдвига внутренних слоев топлива, для упугой деформации, действительно будет параболой, грубо.
Maggot>Предел упругости шашки определяет зависимость толщины стенки шашки от ускорения.
^ не "стенки шашки", а "стенки трубки". Макс. диаметр шашки определяет предел прочности. И закон Гука у нас уже не линейный
 . Т.е. теория упругости вместо сопромата.
. Т.е. теория упругости вместо сопромата.Короче прикидывал я расчет топливной шашки. При не очень грубых допущениях получается 3-и независимые и не нулевые (в первом приближении) компоненты тензора деформации и система из 4-х не совсем линейных дифф ур-ов. 3-и из них я выписал (уравнения равновесия), дальше меня лень задавила (но результаты выложу чуть позже). Подумал я и решил что надо экспериментом смоделировать напряженно-деформированное состояние и получить эмпирическую зависимость.
Для таких видов материала как наше топливо критерием разрушения является достижение некоторой критической деформации (которая больше предела текучести для динамических нагрузок). Модуль упругости и предел текучести топлива влияют только на нагрузку действующую на трубу бронировки. Считая трубку бронировки бесконечно жесткой и отбрасывая неприятный вопрос и касательных напряжениях в материале можно сделать следующий тест.
Изготавливаем из топлива круглую пластину с отверстием по центру. h - толшина, R0 - внутр. R1 - внешн радиусы. Причем толщина кристалической корочки на поверхности топлива должна быть менее 0.1*h.

R0 - диаметр канала.
R - диаметр топливной шашки
R1 = R + (2 .. 3) * h.
P = m * g * n - усилие распределенное по внутреннему радиусу.
m - масса тестовой пластины находящаяся между радиусами R0 и R
( m = h * pi * (R2 - R02) * ro )
g - 9.8 м/с2
n - перегрузка, в разах.
Плавно наращиеваем нагрузку и смотрим при каком усилии начнется разрушение топливной пластины. Из этой критической нагрузки расчитываем макс. перегрузку для заданного диаметра движка.
Чертежи для испытательного стенда рисовать не буду, т.к. рисование чертежей в фотошопе - занятие для джедаев.
Maggot
втянувшийся
timochka>Решил всеж таки привести рисунок как топливо нагружать.
Самое главное не сказал .
.
Для разных диаметров топливных шашек точим только набор шайб 3,4,5. А детали 1 и 2 юзаем одни и те-же, и делаем их побольше. Чтоб все диаметры испытать можно было. Если получится то диаметром 150 - 200 мм.
Самое главное не сказал
 .
.Для разных диаметров топливных шашек точим только набор шайб 3,4,5. А детали 1 и 2 юзаем одни и те-же, и делаем их побольше. Чтоб все диаметры испытать можно было. Если получится то диаметром 150 - 200 мм.
Это про плавление сорбита
Maggot>После охлаждения не затвердела. Через сутки из равной поверхности поднялись кристаллы, поверхность твердая, но глубже жидкость. Еще через сутки без изменений. Поставил в холодильник. Посмотрим.
Разморозил образец. Помогло. По всей толщине однородный твердый материал.
Maggot>После охлаждения не затвердела. Через сутки из равной поверхности поднялись кристаллы, поверхность твердая, но глубже жидкость. Еще через сутки без изменений. Поставил в холодильник. Посмотрим.
Разморозил образец. Помогло. По всей толщине однородный твердый материал.
Maggot
втянувшийся
Maggot>Разморозил образец. Помогло. По всей толщине однородный твердый материал.
Сколько времени морозил? При какой температуре?
Сколько времени морозил? При какой температуре?
 Реклама Google — средство выживания форумов :)
Реклама Google — средство выживания форумов :)
Copyright © Balancer 1997..2018
Создано 08.02.2002
Связь с владельцами и администрацией сайта: anonisimov@gmail.com, rwasp1957@yandex.ru и admin@balancer.ru.
Создано 08.02.2002
Связь с владельцами и администрацией сайта: anonisimov@gmail.com, rwasp1957@yandex.ru и admin@balancer.ru.
 CaRRibeaN
CaRRibeaN

 инфо
инфо инструменты
инструменты algor17
algor17


 Serge77
Serge77

 Maggot
Maggot

